전체뉴스 1-10 / 4,775건
- 최신순
- 정확도순
- 과거순
-
"췌장암 환자 3명 중 2명 의료공백으로 진료 거부 겪어"
환자단체 "필수의료 종사 의료인의 집단행동 방지하는 법 마련돼야" 췌장암 환자 3명 중 2명은 의·정 갈등에 따른 의료 공백으로 진료를 거부당한 적 있는 것으로 조사됐다고 한국암환자권익협의회가 5일 밝혔다. 협의회가 지난달 ... 281명을 대상으로 조사한 결과 응답자의 67%가량은 '진료 거부를 겪었다'고 답한 것으로 나타났다. 51%는 '항암 등 치료가 지연됐다'고 답변했다. 협의회는 지난달 7일에도 췌장암 환자 중 정상 진료를 받은 비율이 35%에 불과하다는 ...
한국경제 | 2024.06.05 17:03 | YONHAP
-
박셀바이오, '바이오 USA'서 간세포암 치료제 2a상 임상결과 발표
항암 면역세포치료제 개발 전문회사 박셀바이오가 미국 샌디에이고에서 열리고 있는 ‘2024 바이오 인터내셔널 컨벤션(이하 ‘바이오 USA’)’에 참가해 주요 파이프라인 연구내용을 발표했다. ... 5.7개월, HAIC 단독군 7.8개월에 비해 두 배 정도 높았고, 전체생존기간(OS)도 기존 치료방식보다 길었다. 난소암 위암 췌장암 등 고형암을 타깃으로 한 PD-L1 · EphA2 이중표적 CAR-T 고형암 치료제는 표적 ...
바이오인사이트 | 2024.06.05 15:44 | 오현아
-
늘어나는 'FDA 희귀의약품' 지정…"R&D 촉진에 도움"
... IIIA) 후보물질 'GC1130A'도 FDA 희귀의약품으로 지정됐다. 산필리포증후군은 유전자 결함으로 조직 발달과 암 전이 등에 관여하는 물질인 '헤파란 황산염'이 체내에 축적돼 뇌 손상을 유발하는 열성 유전 희귀 질환이다. GC1130A는 ... FDA에서 임상 1상 시험 계획(IND)을 승인받았다. 네오이뮨텍의 면역항암제 후보 물질 'NT-I7'도 FDA로부터 췌장암 대상 희귀의약품으로 지정됐다. NT-I7은 면역 세포인 T세포를 증폭시키는 치료제로, T세포 부족으로 면역항암제 ...
바이오인사이트 | 2024.06.04 09:00 | YONHAP
-
[이달의 논문 리뷰] 소분자 표적항암제 개발의 최신 동향
... 리페어(Mismatch Repair, MMR)는 DNA 복제 과정에서 발생하는 돌연변이를 교정하는 기전으로, 대장암·자궁내막암·난소암·위암 등 여러 암종의 10~30%에서 MMR 시스템의 문제가 ... G12C 특이적 억제제인 소토라십(Sotorasib)과 아다그라십(Adagrasib)이 개발돼 G12C 변이 양성 고형암 치료제로 승인됐으나, 이는 췌장암의 1% 미만에서만 나타나는 드문 변이다. 따라서 보다 광범위한 KRAS 변이를 ...
바이오인사이트 | 2024.06.04 08:34 | 김예나
-
[ASCO 2024]큐리언트 "Q901·ADC 병용 가능한 충분한 안전성 입증"
... 발표한 이후 관심과 질문이 쏟아졌다고 말했다. 큐리언트는 지난 1일 CDK7 억제제인 Q901 임상 중간 결과 암종에 관계없이 모든 용량 구간에서 내약성과 안전성이 증명됐다는 내용을 현장에서 발표했다. CDK7는 세포의 분열 ... 수 없는 옵션이 없는 고형암 환자를 무작위로 받았는데 효과를 보였다는게 긍정적인 결과"라고 했다. 대상 암종은 암종은 전이성 난소암, 거세저항성 전립선암, 유방암, 자궁내막암, 대장암, 소세포폐암, 췌장암 등이었다. 2026년경 ...
바이오인사이트 | 2024.06.04 08:12 | 이영애
-
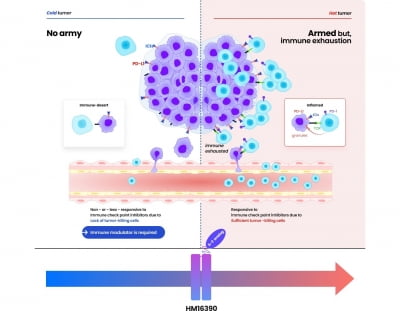
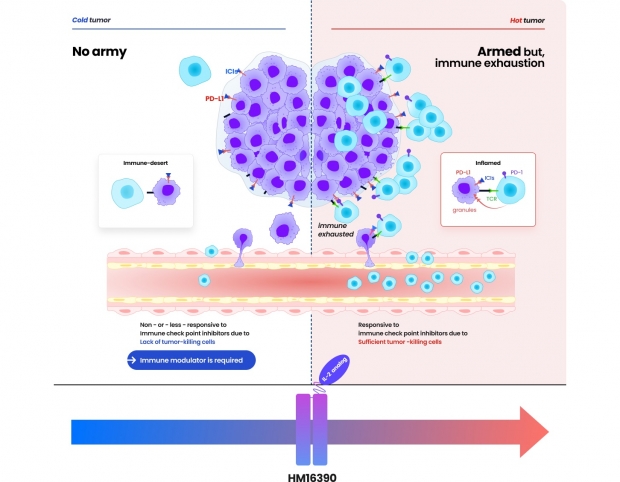
한미약품, 면역조절 항암신약 美 임상 신청
한미약품은 미국 식품의약국(FDA)에 면역조절 항암 혁신신약 ‘HM16390’의 임상 1상 진입을 위한 임상시험계획(IND)을 신청했다고 3일 밝혔다. 진행성 또는 전이성 고형암 환자를 대상으로 HM16390의 ... 기술인 ‘랩스커버리’를 적용해 효능과 안전성, 지속성을 극대화한 면역조절 항암 혁신신약이다. 항암 약물 치료 주기당 1회 피하 투여가 가능한 지속형 제제다. 흑색종, 대장암뿐 아니라 신장암, 췌장선암 등 여러 암종의 ...
바이오인사이트 | 2024.06.03 18:10 | 김유림
-
한미약품, 면역조절 항암 혁신신약 FDA 임상 1상 IND 신청
한미약품은 지난달 말 미국 식품의약국(FDA)에 면역조절 항암 혁신신약 ‘HM16390’의 임상 1상 진입을 위한 임상시험계획(IND)을 신청했다고 3일 밝혔다. 진행성 또는 전이성 고형암 환자를 대상으로 ... 치료 주기당 1회 피하 투여가 가능한 지속형 제제이다. 기존의 IL-2 제제와는 차별화된 수용체 결합력을 통해 항암 효능이 크게 향상됐다. 흑색종과 대장암뿐 아니라 신장암과 췌장선암의 동물모델 등에서 확인된 우수한 효능을 바탕으로 ...
바이오인사이트 | 2024.06.03 14:27 | 김유림
-
한미약품, 면역조절 항암신약 후보의 미국 임상 1상 IND 신청
한미약품은 면역 조절 매커니즘의 항암 신약 후보 HM16390의 미국 임상 1상 시험계획(IDN)의 승인을 미 식품의약국(FDA)에 신청했다고 3일 밝혔다. HM16390은 면역세포의 분화와 증식을 통해 면역 기능을 조절하는 ...;를 적용해 효능과 안전성, 지속성을 극대화했다고 회사 측은 강조했다. 한미약품은 동물모델을 통해 흑색종, 대장암, 신장암, 췌장선암 등에서 HM16390의 효과를 확인했다고 한다. 한미약품은 HM16390를 면역관문억제제와 ...
한국경제 | 2024.06.03 13:30 | 한경우
-
한미약품, 차세대 면역조절 항암 혁신신약, 美 FDA에 임상 1상 IND 신청〈LAPS IL-2 analog, HM16390〉
한미약품은 지난달 말 미국 식품의약국(FDA)에 면역조절 항암 혁신신약(LAPS IL-2 analog, 코드명: HM16390)의 임상 1상 진입을 위한 임상시험계획(IND)을 신청했다고 3일 밝혔다. 진행성 또는 전이성 고형암 ... 치료 주기당 1회 피하 투여가 가능한 지속형 제제로, 기존의 IL-2 제제와는 차별화된 수용체 결합력을 통해 항암 효능이 크게 향상됐다. 흑색종과 대장암뿐 아니라 신장암과 췌장선암의 동물모델 등에서 확인된 우수한 효능을 바탕으로 ...
한국경제 | 2024.06.03 11:38 | WISEPRESS
-
네오이뮨텍, ASCO에서 NT-I7 생존기간 데이터 첫 공개
... 기반 세포치료제업체 네오이뮨텍이 미국임상종양학회(ASCO)에서 자사 후보물질 ‘NT-I7’의 췌장암 생존기간(OS)데이터를 처음으로 공개했다. 네오이뮨텍은 4일(미국 시간)까지 열리는 ASCO에서 NT-I7의 주요 ... 면역관문억제제 ‘키트루다’(성분명 펨브롤리주맙)를 무상지원 받아 NT-I7과 키트루다를 병용한 고형암 대상 임상시험이다. 면역관문억제제 단독으로는 효과가 없다고 알려진 췌장암, MSS 대장암 환자에서 앞서 긍정적인 ...
바이오인사이트 | 2024.06.03 10:57 | 이우상