전체뉴스 91-100 / 26,709건
- 최신순
- 정확도순
- 과거순
-
"FDA 승인 획득"…코어라인소프트, 미국 간다 [엔터프라이스]
... 것을, 흉부CT만으로도 진단이 가능하게 하는 제품입니다. 코어라인소프트 측은 논 게이티드(non-gated) 기술이 드물기 때문에 당장의 경쟁 제품이나 비슷하게 엮이는 제품은 없다고 설명하기도 했습니다. 사실 코어라인소프트 제품이 FDA 승인을 받은 게 이번이 처음은 아니기도 합니다. '에이뷰'라는 게 코어라인소프트의 AI 기반 제품들의 브랜드 네임 같은 건데, 앞서 9개 제품에 대해 승인을 받은 바 있습니다. 알겠습니다. 정 기자, FDA 승인을 받았다면 미국 ...
한국경제TV | 2024.04.02 15:04
-
美액섬, SK바이오팜 '수노시' 폭식장애 3상 시작
... disorder, BED) 임상 3상을 시작했다고 1일(현지시간) 밝혔다. 수노시는 기존에 기면증 또는 폐쇄성 수면 무호흡증(OSA)으로 인한 과도한 졸림(EDS) 치료제로 사용되는 약이다. 2019년과 2020년에 각각 미국 식품의약국(FDA)과 유럽의약품청(EMA)으로부터 품목허가를 받았다. BED는 단기간 내에 과도한 양의 음식을 반복적으로 섭취하는 만성 질환이다. 식사에 대한 통제력이 부족하고 폭식에 대해 괴로움을 느낀다. BED는 신경성 폭식증(bulimia ...
바이오인사이트 | 2024.04.02 11:57 | 박인혁
-
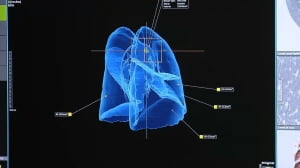
코어라인소프트 'AVIEW CAC', 美FDA서 의료기기 인증
코어라인소프트가 미국 식품의약국(FDA)으로부터 AI 기반 관상동맥석회화 자동 진단솔루션 'AVIEW CAC'(에이뷰 씨에이씨)'의 510(K) 인증을 획득했다고 2일 밝혔다. AVIEW CAC는 국내에서 식약처 의료기기 3등급을 획득한 의료기기로, 심장 영상 뿐 아니라 흉부CT를 통해 관상동맥석회화 수치를 알려준다. 510(K)는 미국 시장에 의료기기를 판매하기 위해 받아야 하는 인증이다. 코어라인소프트는 2018년 AI 기반 통합 제품군인 'AVIEW'로 ...
한국경제TV | 2024.04.02 10:50
-
잘 나가고 있었는데…바이오 개미들 '비명'
... 한편, 한승연 NH투자증권 연구원은 "국내 코스피 제약사들의 시총은 상대적으로 제자리걸음이며, 오히려 실적이 없는 코스닥 기업은 미래 신약 가치 반영으로 기업 밸류가 높게 형성되어 있다"고 밝혔다. 이어 한 연구원은 "국내 제약·바이오 기업들은 글로벌 주요 제약사와 큰 규모의 딜을 수차례 진행해 왔으나 아직 미국 FDA 승인받은 국산 신약은 7개뿐으로 대형 매출이 발생하는 의약품은 전무하다"고 설명했다. 김동하기자 hdk@wowtv.co.kr
한국경제TV | 2024.04.02 10:10
-
동아에스티, 뉴로보 MASH 신약 올해 말 2상 완료
... 올해 안에 마무리하겠다는 계획을 내놨다. 뉴로보는 MASH치료제로 개발하고 있는 'DA-1241'의 글로벌 임상 2a상 환자 모집을 마쳤다고 2일 발표했다. 뉴류보 파마슈티컬스는 지난해 5월 미국 식품의약국(FDA)으로부터 DA-1241 글로벌 임상 2a상을 승인받았다. 같은 해 9월 첫 환자 투약을 시작했다. DA-1241 글로벌 임상 2a상은 49명의 MASH 환자를 위약군과 DA-1241 50㎎군, DA-1241 100㎎군으로 나눠 ...
바이오인사이트 | 2024.04.02 09:38 | 이지현
-
"오스코텍, 빅파마 로열티 받는 최초 바이오…목표가 4만원 제시"-대신
... 이희영 대신증권 연구원은 ”오스코텍은 유한양행의 오픈이노베이션(개방형 혁신) 전략을 통해 개발 중이던 신약의 상업화에 성공했다“며 ”아미반타맙·레이저티닙 병용요법이 미 식품의약국(FDA) 우선심사 대상으로 상정돼 글로벌 진출도 앞두고 있다“고 말했다. 아미반타맙·레이저티닙 병용요법은 유한양행으로부터 레이저티닙을 도입한 얀센 주도로 미국 내 상업화가 추진되고 있다. 이 연구원은 ”8월 ...
한국경제 | 2024.04.02 07:28 | 한경우
-
액섬 테라퓨틱스(AXSM) 수시 보고
... 12주 동안 진행되는 임상시험에 참여할 예정이다. 첫 번째 환자는 2024년 3월에 검사를 받았습니다. 도파민 및 노르에피네프린 재흡수 억제제이자 미량 아민 관련 수용체 1(TAAR1) 작용제인 솔리암페톨은 아직 BED 치료에 대해 FDA로부터 승인을 받지 못했습니다. 중추신경계(CNS) 질환에 대한 새로운 치료법 개발에 주력하는 바이오제약회사인 Axsome Therapeutics, Inc.는 회사의 미래 전망을 논의하는 성명을 발표했습니다. 이 성명에는 잠재적인 향후 결과와 ...
한국경제 | 2024.04.01 21:32 | 굿모닝 로보뉴스
-
한미약품, "비만 치료 삼중작용제, 美에 임상 1상 계획 신청"
한미약품이 미국 식품의약청(FDA)에 비만 치료 삼중 작용제 후보물질(코드명 HM15275)의 임상 1상 시험 계획을 신청했다고 1일 밝혔다. 회사는 건강하거나 비만한 성인 환자를 대상으로 HM15275의 안전성과 내약성 등을 평가할 예정이다. 한미약품에 따르면 HM15275는 식욕 억제를 돕는 글루카곤 유사 펩타이드-1(GLP-1), 인슐린 분비 자극 펩타이드(GIP), 에너지 소비를 촉진해 체중 감소 효과를 내는 글루카곤(GCG)의 작용을 ...
바이오인사이트 | 2024.04.01 15:22 | YONHAP
-
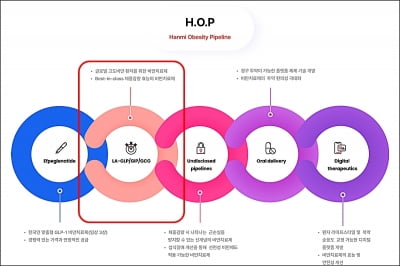
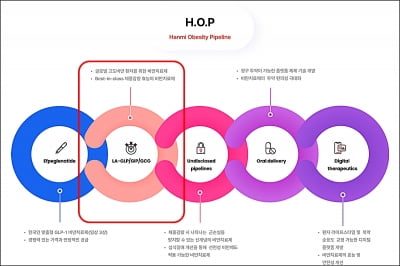
한미약품, 차세대 비만치료제 美FDA 임상 1상 IND
한미약품이 지난 3월 29일(미국 현지시각) 미국 식품의약국(FDA)에 차세대 비만 치료 삼중작용제(LA-GLP/GIP/GCG, 코드명 HM15275)의 임상 1상 진입을 위한 임상시험계획(IND)을 신청했다고 1일 밝혔다. 성인 건강인 및 비만 환자를 대상으로 HM15275의 안전성과 내약성, 약동학, 약력학 특성 등을 평가하는 내용의 임상시험계획이다. 한미약품은 HM15275의 상용화 목표 시점을 2030년으로 설정했으며, 지난 2월 29일에는 ...
한국경제TV | 2024.04.01 15:07
-
한미약품, 차세대 비만 삼중작용제 美 1상 IND 제출
한미약품이 최근 미국 식품의약국(FDA)에 차세대 비만 치료 삼중작용제(HM15275) 임상 1상 진입을 위한 임상시험계획(IND)을 신청했다고 1일 발표했다. 한미약품은 HM15275의 상용화 목표 시점을 2030년으로 정하고 지난 2월 29일 한국 식품의약품안전처에 IND를 제출했다. HM15275는 현재 임상 3상시험을 진행하고 있는 에페글레나타이드의 후속 비만 신약이다. 글루카곤 유사 펩타이드(GLP-1)와 위 억제 펩타이드(GIP), ...
바이오인사이트 | 2024.04.01 14:43 | 이지현